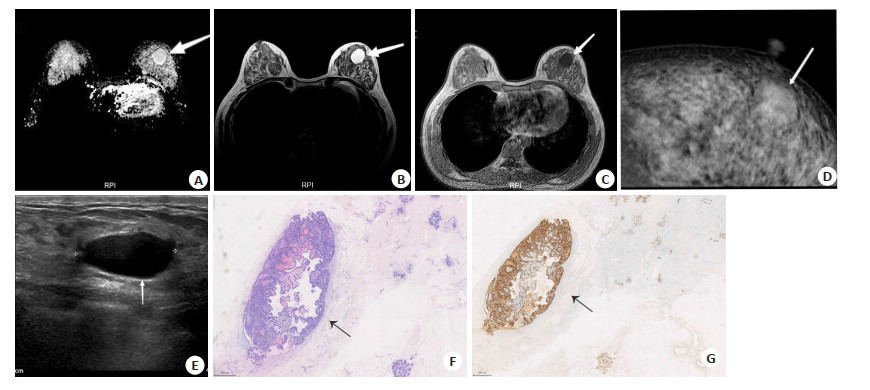
Clinical and imaging characteristics of papillary carcinoma of the breast
-
摘要:
目的 研究乳腺乳头状癌病理亚型病例的超声(US)、乳房X线摄影(MG)和MRI影像图谱,对比分析乳头状癌病理亚型病例的临床和影像特征差异及其临床意义。 方法 收集2012年2月~2021年12月病理确诊的47例乳腺乳头状癌患者临床和影像学检查资料。根据世界卫生组织最新肿瘤组织学分类,将纳入的47例患者(49个病灶)分为4组:乳头状导管原位癌(pDCIS)组、包裹性乳头状癌(EPC)组、实体性乳头状癌(SPC)组和浸润性乳头状癌(IPC)组。比较不同病理组的临床特征(n=47)、US(n=47)、MG(n=45)和MRI(n=14)的影像特征差异。根据BI-RADS分类标准,将BI-RADS分类≥4A认为是阳性诊断,分析3种影像学的误诊率。 结果 临床特征:所有组中触及包块比乳头溢液更多见。pDCIS(9/16,56.3%)亚组乳头溢液占比最高,IPC亚组触诊到包块的占比最高(9/11,81.8%)。US影像特征:IPC亚组的肿块形态不规则占比高于EPC亚组(P=0.023);IPC亚组的肿块边界不清占比远高于SPC组(P=0.025);与pDCIS相比,EPC亚组的囊实性肿块占比更高(P=0.048)。MG影像特征:SPC亚组肿块形态不规则的占比最高(4/6,66.7%),EPC亚组表现为形态规则的占比最高(5/6,83.3%); 在肿块边界不清或星芒状特征方面,SPC亚组占比高于pDCIS亚组(P=0.015)。MRI影像特征:SPC组的ADC低于其他亚组(ADC=0.37×10-3 mm2/s,P=0.005),EPC亚组低于pDCIS亚组(P=0.017)。US、MG及MRI的误诊率分别为46.8%、37.8%及14.3%,US的误诊率高于MRI(P=0.029)。 结论 乳腺乳头状癌亚组之间影像特征存在重叠。虽然US和MRI均可显示肿瘤形态学特征,但US误诊率显著高于MRI。MG对肿瘤钙化类型和分布更敏感,MRI在发现肿瘤扩散及伴发的同时性肿瘤方面更有效。US显示的肿块内血流信号、US和MG显示的肿块边缘及形态、MRI表观扩散系数等影像特征在乳腺乳头状癌病理亚型病例中存在差异。 Abstract:Objective To investigate the ultrasound (US), mammography (MG) and MRI profiles of the pathological subtypes of papillary carcinoma of the breast, to compare and analyze the differences of clinical and imaging features and clinical significance of the pathological subtypes of papillary carcinoma. Methods The clinical and imaging data of 47 patients with pathologically confirmed breast papillary carcinoma from February 2012 to December 2021 were collected. According to the latest tumor histological classification of World Health Organization, the patients were divided into four groups: papillary ductal carcinoma in situ (pDCIS), encapsulated papillary carcinoma (EPC), solid papillary carcinoma (SPC) and invasive papillary carcinoma (IPC) groups. The clinical features (n=47), ultrasound (n=47), MG (n=45) and MRI (n=14) of different pathological groups were compared. According to the BI-RADS classification criteria, BI-RADS classification ≥4A was considered as a positive diagnosis, and the misdiagnosis rate of the three imaging methods was analyzed. Results Clinical features: Palpable mass was more common than nipple discharge in all groups. pDCIS (9/16, 56.3%) had the highest proportion of nipple discharge, and IPC (9/11, 81.8%) had the highest proportion of palpation of mass. US imaging features: The proportion of irregular mass shape in IPC subgroup was also significantly higher than that in EPC subgroup (P=0.023). The proportion of unclear mass boundary in IPC subgroup was much higher than that in SPC group (P=0.025). Compared with pDCIS, EPC subgroup had a higher proportion of cystic solid mass (P=0.048). MG imaging features: The SPC subgroup had the highest proportion of irregular mass shape (4/6, 66.7%), and the EPC subgroup had the highest proportion of regular mass shape (5/6, 83.3%). The proportion of the SPC subgroup was higher than that of the pDCIS subgroup (P=0.015). MRI imaging features: The ADC of SPC group was lower than that of other subgroups (ADC=0.37×10-3 mm2/s, P=0.005), and EPC group was lower than pDCIS subgroup (P=0.017). The misdiagnosis rates of US, MG and MRI were 46.8%, 37.8% and 14.3%, respectively, and the misdiagnosis rate of US was significantly higher than that of MRI (P=0.029). Conclusion The imaging features of papillary breast carcinoma subgroups overlap. Although both US and MRI can show the morphological characteristics of tumors, the misdiagnosis rate of US is significantly higher than that of MRI. MG is more sensitive to the type and distribution of tumor calcification, and MRI is more effective in detecting tumor spread and concurrent tumors. The blood flow signal in the mass shown by US, the margin and morphology of the mass shown by US and MG, and the apparent diffusion coefficient of MRI are different in the histological subtypes of breast papillary carcinoma. -
Key words:
- papillary carcinoma of breast /
- subtypes /
- ultrasound /
- mammography /
- magnetic resonance imaging
-
表 1 乳腺乳头状癌病理亚型患者的一般临床特征
Table 1. General clinical characteristics of patients with pathological subtypes of breast papillary carcinoma
指标 pDCIS组(n=16) EPC组(n=10) SPC组(n=10) IPC组(n=11) P 中位年龄(岁) 58(38~88) 48(34~68) 43(31~81) 48(29~75) 0.734 病变侧[n(%)] 0.909 右侧 6(37.5) 4(45.5) 3(30.0) 5(45.5) 左侧 10(62.5) 6(54.5) 7(70.0) 6(54.5) 乳头溢液[n(%)] 0.272 有 9(56.3) 2(20.0) 3(30.0) 4(36.3) 无 7(43.75) 8(80.0) 7(70.0) 7(63.7) 触诊包块[n(%)] 0.606 有 10(62.5) 8(80.0) 8(80.0) 9(81.8) 无 6(37.5) 2(20.0) 2(20.0) 2(18.2) 包块位置[n(%)] 0.602 中心 6(37.5) 5(50.0) 7(70.0) 5(45.5) 边缘 4(25.0) 3(30.0) 1(10.0) 4(36.3) 包块大小(平均最大直径,cm,Mean±SD) 3.1±1.57 2.5±1.21 2.8±1.15 3.7±1.29 0.116 乳房实质构成[n(%)] 0.718 A 1(6.25) 0(0.0) 0(0.0) 0(0.0) B 2(12.5) 4(40.0) 3(30.0) 4(36.3) C 12(75.0) 5(50.0) 7(70.0) 5(45.5) D 1(6.25) 1(10.0) 0(0.0) 2(18.2) 淋巴结[n(%)] 0.458 阳性 0(0.0) 1(10.0) 0(0.0) 1(9.1) 阴性 16(100.0) 9(90.0) 10(100.0) 10(90.9) pDCIS: 乳头状导管原位癌; EPC: 包裹性乳头状癌; SPC: 实性乳头状癌; IPC: 浸润性乳头状癌. 表 2 乳腺乳头状癌病理亚型患者的US特征
Table 2. US characteristics of patients with pathological subtypes of breast papillary carcinoma [n(%)]
特征 pDCIS组(n=16) EPC组(n=10) SPC组(n=10) IPC组(n=11) P 肿块 13 9 9 11 肿块形状 规则形 6(37.5) 7(70.0) 6(60.0) 3(27.3) 0.109 不规则形 7(43.75) 2(20.0) 3(30.0) 8(72.7) 0.532 肿块边缘 0.111 清晰 8(50.0) 6(60.0) 7(70.0) 3(27.3) 不清晰 5(31.25) 3(30.0) 2(20.0) 8(72.7) 肿块内部回声 0.041 无回声 0(0.0) 1(10.0) 3(30.0) 1(9.1) 混合回声 1(6.25) 4(40.0) 0(0.0) 2(18.2) 低回声 12(75.0) 4(40.0) 6(60.0) 8(72.7) 肿块后方回声 0.596 无改变 10(62.5) 4(40.0) 5(50.0) 6(54.5) 增强 2(12.5) 5(50.0) 3(30.0) 4(36.4) 衰减 1(6.25) 0(0.0) 1(10.0) 1(9.1) 纵横比 0.493 ≥1 3(18.75) 2(20.0) 0(0.0) 2(18.2) < 1 10(62.5) 7(70.0) 9(90.0) 9(81.8) 肿块内血流 0.175 无 5(31.25) 3(30.0) 7(70.0) 4(36.4) 有 8(50.0) 6(60.0) 2(20.0) 7(63.6) 肿块内钙化 0.744 无 10(62.5) 7(70.0) 8(80.0) 10(90.9) 有 3(18.75) 2(20.0) 1(10.0) 1(9.1) 非肿块 3 1 1 0 类型 0.447 不均质回声 2(12.5) 0(0.0) 0(0.0) 0(0.0) 导管扩张 1(6.25) 1(10.0) 1(10.0) 0(0.0) 表 3 乳腺乳头状癌病理亚型患者的MG特征
Table 3. MG characteristics of patients with pathological subtypes of breast papillary carcinoma [n(%)]
特征 pDCIS组(n=16) EPC组(n=8) SPC组(n=10) IPC组(n=11) P 肿块 6 6 6 8 肿块形状 0.325 规则形 4(25.0) 5(62.5) 2(20.0) 4(36.4) 不规则形 2(12.5) 1(12.5) 4(40.0) 4(36.4) 肿块边缘 0.012 清晰 5(31.25) 4(50.0) 0(0.0) 2(18.2) 不清晰 1(6.25) 2(25.0) 6(60.0) 6(54.6) 肿块密度 0.834 等密度 4(25.0) 3(37.5) 3(30.0) 3(27.3) 高密度 2(12.5) 3(37.5) 3(30.0) 5(45.5) 肿块钙化 4(25.0) 4(50.0) 4(40.0) 7(63.6) 0.755 非肿块 10 1 3 2 类型 0.570 非对称性致密 2(12.5) 0(0.0) 0(0.0) 1(9.1) 结构扭曲 2(12.5) 0(0.0) 0(0.0) 0(0.0) 非肿块钙化 9(56.25) 1(12.5) 3(30.0) 1(9.1) 钙化形态 0.052 良性钙化 10(62.5) 5(62.5) 7(70.0) 5(45.5) 可疑钙化 1(6.25) 0(0.0) 0(0.0) 4(36.4) 钙化分布 0.096 良性样分布 9(56.25) 3(37.5) 6(60.0) 3(27.3) 非良性样分布 2(12.5) 2(25.0) 1(0.0) 6(54.6) 表 4 乳腺乳头状癌病理亚型患者的MRI特征
Table 4. MRI characteristics of patients with pathological subtypes of breast papillary carcinoma [n(%)]
特征 pDCIS组(n=5) EPC组(n=3) SPC组(n=2) IPC组(n=4) P 肿块 4 3 2 4 肿块形态 0.131 规则形 1(20.0) 2(66.7) 2(100.0) 0(0.0) 不规则形 3(60.0) 1(33.3) 0(0.0) 4(100.0) 肿块边缘 0.506 清晰 2(40.0) 2(66.7) 2(100.0) 1(25.0) 不清晰 2(40.0) 1(33.3) 0(0.0) 3(75.0) 强化类型 0.277 均匀强化 0(0.0) 2(66.7) 1(50.0) 1(25.0) 不均匀强化 3(60.0) 1(33.3) 1(50.0) 3(60.0) T1WI信号 0.735 低信号 2(40.0) 2(66.7) 2(100.0) 2(50.0) 等信号 1(20.0) 1(33.3) 0(0.0) 2(50.0) 高信号 1(20.0) 0(0.0) 0(0.0) 0(0.0) T2WI信号 0.876 低信号 1(20.0) 0(0.0) 0(0.0) 0(0.0) 等信号 1(20.0) 1(33.3) 0(0.0) 2(40.0) 高信号 2(40.0) 2(66.7) 2(100.0) 2(50.0) DWI信号 0.962 高信号 3(60.0) 3(100.0) 2(100.0) 4(100.0) 低信号 1(20.0) 0(0.0) 0(0.0) 0(0.0) TIC曲线 0.446 II型及以下 2(40.0) 0(0.0) 1(50.0) 1(25.0) III型 2(40.0) 3(100.0) 1(50.0) 3(75.0) 非肿块 2 0 1 0 非肿块分布 1.000 局灶 0(0.0) 0(0.0) 0(0.0) 0(0.0) 节段 2(40.0) 0(0.0) 0(0.0) 0(0.0) 区域 0(0.0) 0(0.0) 1(50.0) 0(0.0) 强化类型 1.000 非肿块样强化 2(40.0) 0(0.0) 1(50.0) 0(0.0) T1WI信号 1.000 低信号 2(40.0) 0(0.0) 1(50.0) 0(0.0) 等信号 0(0.0) 0(0.0) 0(0.0) 0(0.0) T2WI信号 1.000 高信号 2(40.0) 0(0.0) 1(50.0) 0(0.0) 等信号 0(0.0) 0(0.0) 0(0.0) 0(0.0) DWI信号 1.000 高信号 1(20.0) 0(0.0) 1(50.0) 0(0.0) 稍高信号 1(20.0) 0(0.0) 0(0.0) 0(0.0) TIC曲线 1.000 II型及以下 1(20.0) 0(0.0) 0(0.0) 0(0.0) III型 1(20.0) 0(0.0) 1(50.0) 0(0.0) ADC值(×10-3 mm2/s) 1.37(1.28~1.42) 1.04(0.92~1.17) 0.37(0.12~0.62) 1.11(1.08~1.55) 0.003 表 5 BI-RADS分类在US、MG及MRI检查中的误诊率
Table 5. Misdiagnosis rate of BI-RADS classification in US, MG and MRI [n(%)]
BI-RADS分类 pDCIS组(n=16) EPC组(n=10) SPC组(n=10) IPC组(n=11) P 误诊率(%)* US 0.498 46.8 0(n=2) 2(12.5) 0(0.0) 0(0.0) 0(0.0) 1~3(n=20) 5(31.25) 5(50.0) 7(70.0) 3(27.3) 4A(n=10) 3(18.75) 2(20.0) 2(30.0) 3(27.3) 4B(n=7) 3(18.75) 1(10.0) 1(10.0) 2(18.2) 4C(n=5) 1(6.25) 1(10.0) 0(0.0) 3(27.3) 5(n=3) 2(12.5) 1(10.0) 0(0.0) 0(0.0) MG 0.495 37.8 0(n=6) 3(18.75) 0(0.0) 2(20.0) 1(9.1) 1~3(n=13) 4(25.0) 2(25.0) 4(40.0) 1(9.1) 4A(n=13) 5(31.25) 4(50.0) 2(20.0) 2(18.2) 4B(n=6) 2(12.5) 0(0.0) 1(10.0) 3(27.3) 4C(n=8) 1(6.25) 2(25.0) 1(10.0) 4(36.4) 5(n=1) 1(6.25) 0(0.0) 0(0.0) 0(0.0) MRI 0.119 14.3 0(n=1) 0(0.0) 0(0.0) 0(0.0) 1(25.0) 1~3(n=1) 0(0.0) 1(33.3) 0(0.0) 0(0.0) 4A(n=1) 0(0.0) 0(0.0) 1(50.0) 0(0.0) 4B(n=5) 4(80.0) 0(0.0) 0(0.0) 1(25.0) 4C(n=1) 1(20.0) 0(0.0) 0(0.0) 0(0.0) 5(n=5) 0(0.0) 2(66.7) 1(50.0) 2(50.0) *以BI-RADS≥4A为阳性计算误诊率. US: 超声; MG: 乳房X线摄影. -
[1] World Health Organization. Global Health Estimates 2020: Deaths by Cause, Age, Sex, by Country and by Region, 2000-2019[Z/OL]. [2021-02-20]. https://www.who.int/data/gho/data/themes/mortalityand-global-health-estimates/ghe-leading-causes-of-death [2] Brogi E, Horii R, Mac Grogan G, et al. Papillary Neoplasms. Breast Tumours. WHO Classification of Tumours, 5th Edition, Volume 2 [M]. Lyon: WHO Classification of Tumours Editorial Board InternationalAgency for Research on Cancer, 2019: 49-67. [3] Tan PH, Schnitt SJ, van de Vijver MJ, et al. Papillary and neuroendocrine breast lesions: the WHO stance[J]. Histopathology, 2015, 66(6): 761-70. doi: 10.1111/his.12463 [4] Tan PH, Ellis I, Allison K, et al. The 2019 World Health Organization classification of tumours of the breast[J]. Histopathology, 2020, 77 (2): 181-5. doi: 10.1111/his.14091 [5] Marchio C, Horlings HM, Vincent-Salomon A. Invasive Breast Carcinoma. Breast Tumours. WHO Classification of Tumours, 5th Edition, Volume 2[M]. Lyon: WHO Classification of Tumours Editorial Board International Agency for Research on Cancer. 2019: 128-30. [6] Kelten Talu C, Yeni Erdem B, Arslan E, et al. The clinicopathologic features of 22 cases with primary invasive papillary carcinoma of the breast identified in 1153 cases with invasive breast carcinoma: single-center experience[J]. Eur J Breast Health, 2022, 18(4): 360-70. doi: 10.4274/ejbh.galenos.2022.2022-7-4 [7] Tsarouchi MI, Vlachopoulos GF, Karahaliou AN, et al. Multiparametric MRI lesion heterogeneity biomarkers for breast cancer diagnosis[J]. Phys Med, 2020, 80: 101-10. doi: 10.1016/j.ejmp.2020.10.007 [8] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ202110015.htm [9] Bonnet SE, Carter GJ, Berg WA. Encapsulated papillary carcinoma of the breast: imaging features with histopathologic correlation[J]. J Breast Imaging, 2020, 2(6): 590-7. doi: 10.1093/jbi/wbaa068 [10] Kato H, Naiki‐Ito A, Yamada T, et al. The standard form of CD44 as a marker for invasion of encapsulated papillary carcinoma of the breast [J]. Pathol Int, 2020, 70(11): 835-43. doi: 10.1111/pin.13001 [11] Hashmi AA, Munawar S, Rehman N, et al. Invasive papillary carcinoma of the breast: clinicopathological features and hormone receptor profile[J]. Cureus, 2021, 13(2): e13480. [12] You C, Peng WJ, Shen XX, et al. Solid papillary carcinoma of the breast: magnetic resonance mammography, digital mammography, and ultrasound findings[J]. J ComputAssist Tomogr, 2018, 42: 771-5. doi: 10.1097/RCT.0000000000000745 [13] Hashmi AA, Faraz M, Rafique S, et al. Spectrum of papillary breast lesions according to World Health Organization classification of papillary neoplasms of breast[J]. Cureus, 2020, 12(10): e11026. [14] Xie YM, Zhu Y, Chai WM, et al. Downgrade BI-RADS 4A patients using nomogram based on breast magnetic resonance imaging, ultrasound, and mammography[J]. Front Oncol, 2022, 12: 807402. doi: 10.3389/fonc.2022.807402 [15] Speer ME, Adrada BE, Arribas EM, et al. Imaging of intracystic papillary carcinoma[J]. Curr Probl Diagn Radiol, 2019, 48(4): 348-52. doi: 10.1067/j.cpradiol.2018.05.001 [16] Athanasiou A, Khomsi F, de Joliniere B, et al. Encapsulated papillary carcinoma: a case report and review of the literature[J]. Front Surg, 2022, 8: 743881. doi: 10.3389/fsurg.2021.743881 [17] Kulka J, Madaras L, Floris G, et al. Papillary lesions of the breast[J]. VirchowsArch, 2022, 480(1): 65-84. doi: 10.1007/s00428-021-03182-7 [18] Özçağlayan TİK, Öznur M. Digital mammography, ultrasound and magnetic resonance imaging characteristics in differential diagnosis of papillary carcinoma subtypes of the breast and diagnostic challenges[J]. Eur J Breast Health, 2022, 18(2): 172-81. doi: 10.4274/ejbh.galenos.2022.2021-9-4 [19] Fadzli F, Rahmat K, Ramli MT, et al. Spectrum of imaging findings of papillary breast disease: a radiopathological review in a tertiary center[J]. Medicine, 2021, 100(16): e25297. doi: 10.1097/MD.0000000000025297 [20] Lv WJ, Zheng DW, Guan WB, et al. Contribution of diffusionweighted imaging and ADC values to papillary breast lesions[J]. Front Oncol, 2022, 12: 911790. doi: 10.3389/fonc.2022.911790 [21] Tang WJ, Liang YS, Yan J, et al. Magnetic resonance imaging (MRI) phenotypes may provide additional information for risk stratification for encapsulated papillary carcinoma of the breast[J]. Cancer Manag Res, 2020, 12: 11751-60. doi: 10.2147/CMAR.S277980 [22] Hassan Z, Boulos F, Abbas J, et al. Intracystic papillary carcinoma: clinical presentation, patterns of practice, and oncological outcomes [J]. Breast Cancer Res Treat, 2020, 182(2): 317-23. doi: 10.1007/s10549-020-05680-9 -
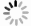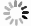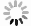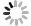






 下载:
下载: