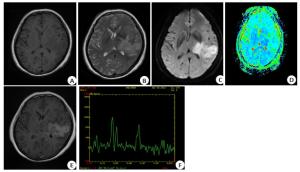
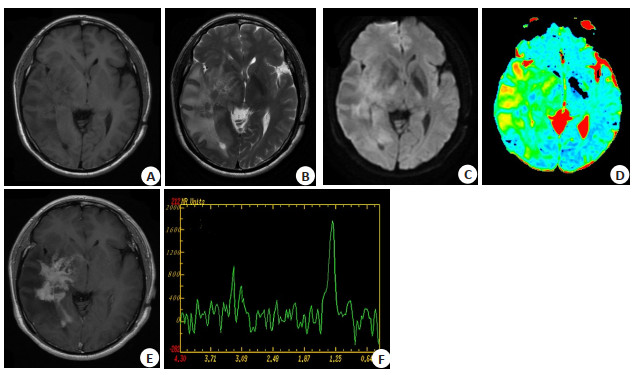
Application of apparent diffusion coefficient value combined with magnetic resonance spectroscopy in diagnosis and differentiation of primary central nervous system lymphoma evaluating by Logistic regression model
-
摘要:
目的在Logistic回归模型下探讨肿瘤不同区域表观扩散系数(ADC)值联合磁共振波谱成像(MRS)代谢产物的相对比值在原发性中枢神经系统淋巴瘤(PCNSL)诊断与鉴别中的应用价值。 方法分析及检测经临床及病理证实32例PCNSL和40例高级别胶质瘤(HGG)常规MRI及扩散加权成像、MRS特征,分别测量肿瘤实质区、近侧瘤周(瘤周1 cm以内的水肿区)、远侧瘤周(瘤周1 cm以外水肿区)及对侧正常脑白质的ADC值,并计算平均值。采用二维多体素1H MRS成像,测量并计算代谢产物相对比值。统计学分析两组肿瘤不同区域ADC值及MRS代谢产物的相对比值的差异,采用二元logistic回归筛选对PCNSL和HGG鉴别价值较高的指标,进行logistic回归分析,并使用ROC曲线分析比较各指标单独诊断及联合诊断对两组肿瘤的诊断效能。 结果PCNSL组与HGG组肿瘤实质、近侧瘤周、远侧瘤周、对侧脑白质的ADC值组内比较总体差异有统计学意义(P < 0.001),两两比较差异有统计学意义(P < 0.05)。PCNSL组与HGG组不同区域ADC值变化趋势分别为:先升后降抛物线型、折线上升型。单独诊断对两者鉴别时,肿瘤实质ADC值对两者的诊断效能最高(曲线下面积=0.880)。PCNSL组与HGG不同区域胆碱复合物(Cho)/肌酸(Cr)、Cho/N-乙酰天门冬氨酸(NAA)、脂质(Lip)/Cr值进行组内比较,总体差异有统计学意义(P < 0.001)。组内两两比较:PCNSL组与HGG组肿瘤实质Cho/Cr、Cho/NAA、Lip/Cr值均大于近侧瘤周、远侧瘤周、对侧脑白质;Lip/Cr在两者肿瘤实质的组间比较中具有显著的统计学意义(t=6.418,P < 0.001)。Logistic回归方程模型为:Logistic(P)=-13.190+1.374×近侧瘤周ADC值+0.542×肿瘤实质Lip/Cr值,高水平的近侧瘤周ADC值和肿瘤实质Lip/Cr值是倾向PCNSL的危险因素。在Logistic回归方程模型下,联合诊断曲线下面积最大(曲线下面积=0.973),鉴别诊断两组的敏感度、特异性分别为:90.6%、97.5%(P < 0.001),联合诊断效能最高。 结论ADC值及MRS不同代谢产物的相对比值测量技术为无创性判断肿瘤及瘤周的微观浸润状态提供病理基础及分子影像学依据,Logistic回归模型下联合诊断可有效提高诊断效能,从而为两者的早期诊断,鉴别和治疗提供可靠依据。 Abstract:ObjectiveTo investigate the application value of the apparent diffusion coefficient (ADC) value of different tumor regions combined with the relative ratio of MRS metabolites in the diagnosis and differentiation of primary central nervous system lymphoma (PCNSL) under Logistic regression model. MethodsThe characteristics of conventional MRI, DWI and MRS in 32 cases of PCNSL and 40 cases of HGG confirmed by clinical and pathology were analyzed and detected. The ADC values of tumor parenchyma, proximal peritumor (edema area within 1cm around the tumor), distal peritumor (edema area beyond 1cm around the tumor) and contralateral normal white matter were measured. The average values were calculated. Two-dimensional multi-voxel 1H MRS imaging was used to measure and calculate the relative ratio of metabolites. The differences of ADC values and the relative ratio of MRS metabolites in different regions of the two groups were analyzed. The indicators with higher differential value of PCNSL and HGG were screened by binary logistic regression analysis, and the diagnostic efficacy of each indicator alone and combined in the diagnosis of tumors in the two groups was compared by ROC curve analysis. ResultsThe overall differences in ADC values of tumor parenchyma, proximal peritumor, distal peritumor and contralateral white matter between PCNSL group and HGG group were significant within the group (all P < 0.001), and the pair comparison was statistically rising significant (all P < 0.05).The variation trend of ADC values in different areas of PCNSL group and HGG group were as follows: first and then falling parabola type and breaking line rising type, respectively. The ADC value of tumor parenchyma had the highest diagnostic efficacy (AUC=0.880) for the differentiation of tumor parenchyma and tumor parenchyma. Choline complex (Cho)/creatine (Cr), Cho/ N-acetyl aspartic acid (NAA) and lipid (Lip)/Cr values in different regions of HGG group and PCNSL group were compared within the group (P < 0.001). Pair comparison within groups: the values of Cho/Cr, Cho/NAA and Lip/Cr in tumor parenchyma of PCNSL group and HGG group were all higher than those of proximal peritumor, distal peritumor and contralateral white matter. The LIP/CR in the tumor parenchyma between the two groups was significantly different (t=6.418, P < 0.001).Logistic regression equation model was as follows: Logistic(P) =-13.190 + 1.374 × ADC value of proximal peritumor +0.542×LIP/Cr value of tumor parenchyma. A high level of ADC value of proximal peritumor and LIP/Cr value of tumor parenchyma were risk factors for PCNSL. Under the Logistic regression equation model, the area under the joint diagnosis curve was the largest (AUC=0.973). The sensitivity and specificity of the two groups were 90.6% and 97.5% (P < 0.001), the combined diagnostic efficacy was the highest. ConclusionThe measurement technique of ADC value and relative ratio of different metabolites of MRS can provide pathological basis and molecular imaging basis for noninvasive diagnosis of tumor and peri-tumor micro-invasion state. Combined diagnosis under Logistic regression model can effectively improve the diagnostic efficiency, thus providing reliable basis for early diagnosis, differentiation and treatment of the two. -
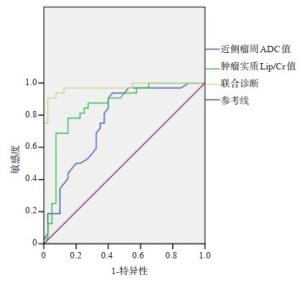
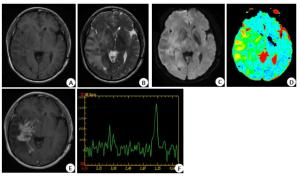
图 4 近侧瘤周ADC值、肿瘤实质Lip/Cr值及联合诊断鉴别诊断PCNSL组与HGG组的操作者工作特征曲线
以联合因子为0.50作为诊断PCNSL的最佳诊断分界点,曲线下面积为0.973(95%CI:0.936~1.000,P < 0.001),敏感度、特异性分别为90.6%、97.5%.
Figure 4. ADC value, Lip/Cr value of tumor parenchyma and operator operating characteristic curve of PCNSL group and HGG group in differential diagnosis.
表 1 两组肿瘤不同区域ADC值(10-3 mm2/s)的比较
Table 1. Comparison of ADC values (10-3 mm2/s) in different regions of the two groups (Mean±SD)
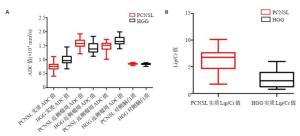
组别 肿瘤实质ADC值 近侧瘤周ADC值 远侧瘤周ADC值 对照侧ADC值 PCNSL组(n=32) 0.76±0.13*#Δ 1.59±0.15#Δ 1.48±0.17Δ 0.85±0.03 HGG组(n=40) 1.00±0.18*#Δ 1.42±0.19#Δ 1.68±0.16Δ 0.84±0.03 t -6.462 4.209 -5.083 0.629 P < 0.001 < 0.001 < 0.001 0.531 ADC:表观扩散系数;PCNSL:原发性中神经系统淋巴瘤;HGG:高级别胶质瘤;*p < 0.05 vs组内近侧瘤周;#p < 0.05 vs组内远侧瘤周;Δp < 0.05 vs组内对照侧. 表 2 不同区域ADC值(×10-3 mm2/s)对PCNSL与HGG鉴别诊断效能分析
Table 2. Efficiency analysis of ADC values(×10-3 mm2/s)in different regions for differential diagnosis of PCNSL and HGG
区域 AUC 95%CI 最佳界值 敏感度(%) 特异性(%) P 肿瘤实质ADC值 0.880 0.801~0.959 0.86 84.4% 80.0% < 0.001 近侧瘤周ADC值 0.762 0.652~0.873 1.405 93.8% 57.5% < 0.001 远侧瘤周ADC值 0.804 0.705~0.903 1.61 81.3% 70.0% < 0.001 表 3 两种肿瘤不同区域1H-MRS代谢物比值比较
Table 3. Comparison of 1H-MRS metabolite ratios in different regions of the two tumors (Mean±SD)
代谢产物相对比值 PCNSL组 HGG组 肿瘤实质 近侧瘤周 远侧瘤周 对侧脑白质 肿瘤实质 近侧瘤周 远侧瘤周 对侧脑白质 Cho/Cr 2.13±0.80*#Δ 1.29±0.29Δ 1.23±0.31Δ 1.0±0.10 1.94±0.73*#Δ 1.41±0.32Δ 1.36±0.48Δ 1.04±0.10 NAA/Cr 1.23±0.36 1.39±0.31 1.40±0.32 1.34±0.22 1.21±0.38 1.27±0.34 1.39±0.36 1.27±0.25 Cho/NAA 1.98±0.83*#Δ 1.27±0.29#Δ 0.96±0.37 0.79±0.25 1.93±0.89*#Δ 1.38±0.40#Δ 0.95±0.37 0.81±0.17 Lip/Cr 6.11±2.14a*# 2.09±0.54# 0.34±0.16 - 2.89±2.1a*# 1.97±0.52# 0.29±0.17 - a两者瘤体实质的Lip/Cr值差异有统计学意义(t=6.418,P < 0.001);*P < 0.05 vs组内近侧瘤周;#P < 0.05 vs组内远侧瘤周;ΔP < 0.05 vs组内对侧脑白质;Lip:脂质;Cr:肌酸;Cho:胆碱复合物;NAA:N-乙酰天门冬氨酸. 表 4 PCNSL组与HGG组ADC值(10-3 mm2/s)、Lip/Cr值二元logistic回归分析
Table 4. ADC values (10-3 mm2/s) and Lip/Cr values of PCNSL group and HGG group were analyzed by binary logistic regression
自变量 偏回归系数 标准误 Wald值 P OR 95%CI 肿瘤实质ADC值 -10.037 7.301 1.890 0.169 < 0.001 < 0.001~71.685 近侧瘤周ADC值 1.374 0.353 15.151 < 0.001 3.950 1.978~7.889 远侧瘤周ADC值 -0.103 0.772 0.018 0.894 0.902 0.199~4.092 肿瘤实质Lip/Cr值 0.542 0.268 4.094 0.043 1.720 1.017~2.910 常数项 -13.190 9.417 1.962 0.161 < 0.001 < 0.001~ < 0.001 表 5 ADC值(10-3 mm2/s)、Lip/Cr值及联合诊断对PCNSL组与HGG组鉴别诊断效能分析
Table 5. ADC values (10-3 mm2/s) and Lip/Cr value and combined diagnosis for differential diagnosis between PCNSL group and HGG group
指标 AUC 95%CI 最佳界值 敏感度(%) 特异性(%) P 近侧瘤周ADC值 0.762 0.652~0.873 1.405 93.8% 57.5% < 0.001 肿瘤实质Lip/Cr值 0.855 0.765~0.945 4.605 78.1% 85.0% < 0.001 联合诊断 0.973 0.936~1.000 0.50 90.6% 97.5% < 0.001 -
[1] Chukwueke UN, Nayak L. Central nervous system lymphoma[J]. Hematol Clin N Am, 2019, 33(4): 597-611. doi: 10.1016/j.hoc.2019.03.008 [2] Yuan XG, Huang YR, Yu T, et al. Primary central nervous system lymphoma in China: a single-center retrospective analysis of 167 cases[J]. Ann Hematol, 2020, 99(1): 93-104. doi: 10.1007/s00277-019-03821-9 [3] Ferreri AJM, Holdhoff M, Nayak L, et al. Evolving treatments for primary central nervous system lymphoma[J]. Am Soc Clin Oncol Educ Book Am Soc Clin Oncol Annu Meet, 2019, 39: 454-66. http://www.researchgate.net/publication/333182012_Evolving_Treatments_for_Primary_Central_Nervous_System_Lymphoma [4] Lai R, Rosenblum MK, DeAngelis LM. Primary CNS lymphoma: a whole-brain disease?[J]. Neurology, 2002, 59(10): 1557-62. doi: 10.1212/01.WNL.0000034256.20173.EA [5] 王雅宁, 王月坤, 孔梓任, 等. 老年高级别胶质瘤的临床特点和治疗[J]. 中华神经外科杂志, 2020, 36(2): 146-50. doi: 10.3760/cma.j.issn.1001-2346.2020.02.008 [6] 任斌, 程岗, 郭志峰, 等. 原发中枢神经系统淋巴瘤临床特征及误诊分析[J]. 临床误诊误治, 2020, 33(12): 21-4. doi: 10.3969/j.issn.1002-3429.2020.12.006 [7] Lin X, Khan IRA, Seet YHC, et al. Atypical radiological findings of primary central nervous system lymphoma[J]. Neuroradiology, 2020, 62(6): 669-76. doi: 10.1007/s00234-020-02377-0 [8] 朱秀芳, 李蕾, 苗重昌, 等. MRI多检查序列联合应用对原发性脑淋巴瘤诊断的价值探讨[J]. 医学影像学杂志, 2016, 26(2): 198-202. https://www.cnki.com.cn/Article/CJFDTOTAL-XYXZ201602005.htm [9] Chen Y, Zhan A. Clinical value of magnetic resonance imaging in identifying multiple cerebral gliomas from primary central nervous system lymphoma[J]. Oncol Lett, 2019, 18(1): 593-8. http://www.ingentaconnect.com/content/sp/ol/2019/00000018/00000001/art00068 [10] 耿磊, 孙毅, 孙志先, 等. MRI鉴别诊断原发性中枢神经系统淋巴瘤与高级别胶质瘤深部病灶[J]. 中国介入影像与治疗学, 2018, 15(2): 95-9. https://www.cnki.com.cn/Article/CJFDTOTAL-JRYX201802013.htm [11] 任瑞, 周金亮, 房俊芳, 等. 脑原发性中枢神经系统淋巴瘤与高级别胶质瘤动脉自旋标记联合弥散加权成像鉴别诊断研究[J]. 中华肿瘤防治杂志, 2019, 26(17): 1274-9. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL201917011.htm [12] Nagashima H, Sasayama T, Tanaka K, et al. Myo-inositol concentration in MR spectroscopy for differentiating high grade glioma from primary central nervous system lymphoma[J]. J Neurooncol, 2018, 136(2): 317-26. doi: 10.1007/s11060-017-2655-x [13] 罗国栋, 孙新海, 翟宁, 等. 原发性中枢神经系统淋巴瘤MRI表现分析[J]. 医学影像学杂志, 2020, 30(3): 354-7. https://www.cnki.com.cn/Article/CJFDTOTAL-XYXZ202003003.htm [14] 耿磊, 汪秀玲, 徐凯. 原发性中枢神经系统淋巴瘤MRI表现及ADC值、rADC值与Ki-67、bcl-2表达的相关性研究[J]. 临床放射学杂志, 2016, 35(12): 1790-5. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS201612002.htm [15] Khan B, Chong I, Ostrom Q, et al. Diffusion-weighted MR imaging histogram analysis in HIV positive and negative patients with primary central nervous system lymphoma as a predictor of outcome and tumor proliferation[J]. Oncotarget, 2020, 11(45): 4093-103. doi: 10.18632/oncotarget.27800 [16] Anwar SSM, Baig MZ, Laghari AA, et al. Accuracy of apparent diffusion coefficients and enhancement ratios on magnetic resonance imaging in differentiating primary cerebral lymphomas from glioblastoma[J]. Neuroradiol J, 2019, 32(5): 328-34. doi: 10.1177/1971400919857556 [17] 孙健, 史艳侠, 范玉华, 等. 原发中枢神经系统淋巴瘤的MRI特点及其在脑组织活检中的应用[J]. 中国神经精神疾病杂志, 2009, 35(8): 472-5. doi: 10.3969/j.issn.1002-0152.2009.08.007 [18] Wang S, Kim SJ, Poptani H, et al. Diagnostic utility of diffusion tensor imaging in differentiating glioblastomas from brain metastases[J]. AJNR Am J Neuroradiol, 2014, 35(5): 928-34. doi: 10.3174/ajnr.A3871 [19] Ko CC, Tai MH, Li CF, et al. Differentiation between glioblastoma multiforme and primary cerebral lymphoma: additional benefits of quantitative diffusion-weighted MR imaging[J]. PLoS One, 2016, 11(9): e0162565. doi: 10.1371/journal.pone.0162565 [20] Haopeng P, Xuefei D, Yan R, et al. Diffusion kurtosis imaging differs between primary central nervous system lymphoma and high-grade glioma and is correlated with the diverse nuclear-to- cytoplasmic ratio: a histopathologic, biopsy-based study[J]. Eur Radiol, 2020, 30(4): 2125-37. doi: 10.1007/s00330-019-06544-7 [21] Moffett JR, Ross B, Arun P, et al. N-Acetylaspartate in the CNS: from neurodiagnostics to neurobiology[J]. Prog Neurobiol, 2007, 81 (2): 89-131. doi: 10.1016/j.pneurobio.2006.12.003 [22] Shimizu H, Kumabe T, Shirane R, et al. Correlation between choline level measured by proton MR spectroscopy and Ki-67 labeling index in gliomas[J]. AJNR Am J Neuroradiol, 2000, 21(4): 659-65. http://www.ncbi.nlm.nih.gov/pubmed/10782774 [23] 李华, 田刚. 多体素磁共振质子波谱在脑胶质瘤诊断中的应用[J]. 中国实验诊断学, 2011, 15(7): 1223-5. doi: 10.3969/j.issn.1007-4287.2011.07.083 [24] Raizer JJ, Koutcher JA, Abrey LE, et al. Proton magnetic resonance spectroscopy in immunocompetent patients with primary central nervous system lymphoma[J]. J Neuro Oncol, 2005, 71(2): 173-80. doi: 10.1007/s11060-004-1360-8 [25] Chawla S, Zhang Y, Wang SM, et al. Proton magnetic resonance spectroscopy in differentiating glioblastomas from primary cerebral lymphomas and brain metastases[J]. J Comput Assist Tomogr, 2010, 34(6): 836-41. doi: 10.1097/RCT.0b013e3181ec554e [26] Kawai N, Okada M, Haba R, et al. Insufficiency of positron emission tomography and magnetic resonance spectroscopy in the diagnosis of intravascular lymphoma of the central nervous system[J]. Case Rep Oncol, 2012, 5(2): 339-46. doi: 10.1159/000339963 [27] 胡旭磊, 何涛, 孙胜玉, 等. 氢质子磁共振波谱成像在脑胶质瘤诊断中的研究进展[J]. 中国临床神经外科杂志, 2020, 25(7): 485-7. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC202007027.htm [28] 刘旋辉, 蒋碧玉, 邝智飞. 原发性中枢神经系统淋巴瘤常规和功能磁共振成像的特点及诊断价值分析[J]. 中国CT和MRI杂志, 2018, 16 (11): 18-20. doi: 10.3969/j.issn.1672-5131.2018.11.006 [29] 史旭波, 黄贵生, 刘扬虹, 等. MR动态增强扫描与扩散加权成像联合应用对腮腺良恶性肿瘤的诊断价值[J]. 分子影像学杂志, 2020, 43 (2): 235-41. doi: 10.12122/j.issn.1674-4500.2020.02.12 [30] 郝光宇, 陈蒙, 姚沉非, 等. 颅内原发性淋巴瘤的MRI诊断及病理分析[J]. 中国血液流变学杂志, 2018, 28(3): 340-3. doi: 10.3969/j.issn.1009-881X.2018.03.029 [31] 薛旭涛, 张箭, 杨如武, 等. 联合应用单体素长TE1H-MRS与ADC在高级别胶质瘤与原发性中枢神经系统淋巴瘤中的鉴别价值[J]. 临床放射学杂志, 2019, 38(11): 2194-9. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS201911044.htm -





 下载:
下载: