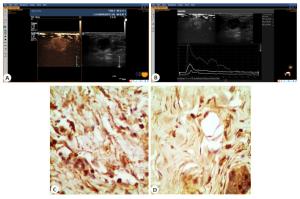
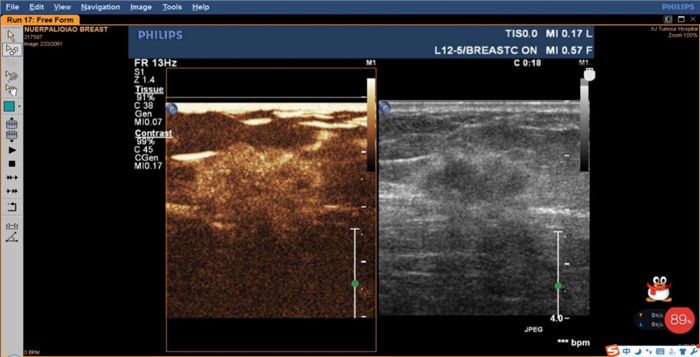
Correlation between contrast-enhanced ultrasound and clinicopathological indicators and TAF in breast cancer
-
摘要:
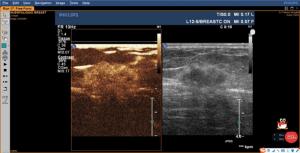
目的分析乳腺癌超声造影指标与临床病理的关联性,探索与超声造影指标相关性较强的病理因子与肿瘤相关成纤维细胞(TAF)相关性的数量分布特点。 方法纳入119例乳腺癌患者,采用超声造影的手段,记录乳腺癌超声造影特征,将乳腺癌肿块的活跃边缘带及病灶旁正常带进行标记,采用免疫组化对靶细胞进行标记,以及形态学的特征来确认TAF细胞,并进行统计分析。 结果当乳腺癌肿块>2 cm、组织学分级高、临床分期早时,超声造影后肿块边界增大,呈高增强,呈现灌注缺损、出现穿支血流几率高(P < 0.05)。超声造影后呈现充盈缺损状态,癌旁正常带的TAF细胞数量较多(P < 0.05)。造影后出现高增强,在活跃边缘带的TAF细胞数量多(P < 0.05)。当病灶较大时,活跃边缘带TAF数量较多(P < 0.05)。当临床分期早、组织学分级高时,两个区域的TAF数量较多(P < 0.05)。而乳腺癌造影后病灶的增强范围与病灶活跃边缘带及癌旁正常带的TAF数量均无关联(P> 0.05)。超声造影后的充盈缺损状态与边缘活跃带的TAF的数量无关联(P>0.05),且病灶的造影增强程度与癌旁的正常带的TAF数量无关(P>0.05)。 结论TAF是乳腺癌预后不良的因素,TAF的数量在一定程度上反映乳腺癌的分化和转移力。 Abstract:ObjectiveTo analyze the correlation between clinic-pathological and CEUS indicators in breast cancer anf explored the correlation between factors with good correlation with CEUS qualitative indicators and the characteristics of TAF in breast cancer. MethodsA total of 119 breast cancer patients were included in the study. CEUS was used to record the characteristics of CEUS. Marked the active marginal band of breast cancer mass and the normal band beside the lesion and marked the study section of mass. Immunohistochemical examination was performed. Target cells were labeled and combined with morphological characteristics to differentiate TAF cells. SPSS22.0 was adopted for statistical analysis. ResultsWhen the mass of breast cancer was more than 2 cm, the histological grade and clinical stage were higher, and the mass range, high enhancement, the probability of perfusion defect and perforator blood flow in contrast-enhanced were higher (P < 0.05). If there was filling defect, the distribution of TAF in the normal adjacent zone increased (P < 0.05). If there was high enhancement after mammography, the distribution of TAF in the active marginal zone of breast cancer increased (P < 0.05). When the lesions were large, TAF in the active marginal zone was more distributed (P < 0.05). When the clinical stage and histological grade were higher, the TAF of the two regions were higher (P < 0.05). But there was no correlation between the enhancement range and the distribution of TAF in the active marginal zone and the normal adjacent zone (P>0.05). There was no correlation between the occurrence of filling defect and the distribution of TAF in the active marginal zone (P>0.05). So the degree of contrast had nothing to do with the distribution of TAF in the normal zone (P>0.05). ConclusionTAF is a factor for poor prognosis of breast cancer. The number of TAF reflected the differentiation and metastasis of breast cancer to a certain extent. -
表 1 纳入119例患者基本特征
Table 1. Basic characteristics of 119 patients included
临床病理特征 n(%) 发病年龄(岁) ≤50 76(63.87) > 50 43(36.13) 绝经状态 绝经前 72(60.50) 绝经后 47(39.50) 腋窝淋巴结状态 阴性 90(75.63) 阳性 29(24.37) 初潮年龄(岁) ≤13 55(46.22) > 13 64(53.78) 组织学特点 原位癌 12(10.08) 浸润性癌 91(76.47) 浸润性癌伴原位癌成分 16(13.45) 肿瘤长径 ≤2 (cm) 47(39.50) > 2 (cm) 72(60.50) 组织学分级 0级及Ⅰ级 15(12.60) Ⅱ级 71(59.66) Ⅲ级 33(27.73) TNM分期 ≤1期 32(26.89) > 1期 87(73.11) ER 阴性 38(31.93) 阳性 81(68.07) PR 阴性 46(38.66) 阳性 73(61.34) Her2 阴性 63(52.94) 阳性 56(47.06) Ki67 阴性 32(26.89) 阳性 87(73.11) 三阴性表型 11(9.24) 表 2 超声造影指标与临床病理因子的关系
Table 2. Relationship between CEUS index and clinic-pathological factors
预后因子 病灶增强范围 灌注缺损 增强形态 增强边界 增强程度 造影剂分布 增强顺序 造影模式 穿支血流 肿块大小 r 0.243 0.239 0.017 0.101 0.220 0.188 0.037 0.164 0.191 P 0.006 0.007 0.851 0.266 0.014 0.114 0.690 0.191 0.034 组织学分级 r 0.398 0.319 0.137 0.132 0.232 0.149 0.122 0.244 0.186 P 0.001 0.001 0.322 0.346 0.033 0.610 0.405 0.109 0.120 临床分期 r 0.239 0.237 0.918 0.182 0.238 0.077 0.112 0.166 0.107 P 0.007 0.008 0.009 0.043 0.008 0.704 0.217 0.187 0.242 表 3 临床病理因子在超声造影中的分布差异
Table 3. Distribution difference of prognostic factors in CEUS [n (%)]
预后因子 病灶增强范围 增强程度 增强边界 灌注缺损 穿支血流 二维 > 二维 低 高 不清晰 清晰 无 有 无 有 肿块大小(cm) < 2 20 27 18 29 33 14 39 8 22 25 > 2 14 58 13 59 47 15 43 29 20 52 χ2 7.441 6.049 1.237 7.179 4.510 P 0.008 0.019 0.283 0.009 0.049 组织学分级 0~1级 12 3 7 8 11 4 15 0 7 8 2级 16 55 20 51 51 20 51 20 28 43 3级 6 27 4 29 28 5 16 17 7 26 χ2 22.453 6.799 2.120 13.476 4.248 P 0.000 0.033 0.346 0.001 0.120 临床分期 0~1期 15 17 14 18 20 12 28 4 14 18 ≥2期 19 68 17 70 70 17 54 33 28 59 χ2 7.185 7.118 4.094 7.062 1.370 P 0.011 0.010 0.043 0.008 0.282 表 4 乳腺癌活性边缘带与正常带TAF在超声造影特征中的差异
Table 4. Difference of CEUS characteristics between active marginal band and normal band TAF in breast cancer (Mean±SD)
区域差异 增强范围 t P 充盈缺损 t P 增强程度 t P 大于 等于 有 无 高增强 非高增强 边缘带 34.03±6.05 33.04±7.01 0.74 0.46 34.89±6.049 33.31±6.34 1.28 0.20 35.89±4.75 27.87±6.33 7.38 0.00 正常带 9.80±3.22 8.89±2.68 1.36 0.18 10.59±2.91 9.13±3.11 2.42 0.02 9.82±3.10 8.94±3.11 1.36 0.18 表 5 乳腺癌活性边缘带与正常带TAF在预后因子分布中的差异
Table 5. Difference of prognostic factor distribution between active marginal band and normal band TAF in breast cancer (Mean±SD)
区域差异 肿瘤大小 t P 临床分期 t P 织学分级 F P 2 cm以上 2 cm以下 大于1期 1期以下 1级 2级 3级 边缘 35.07±5.84 31.85±6.46 2.82 0.01 35.63±5.49 28.81±5.56 5.99 0.00 28.13±5.74 33.12±3.99 35.31±6.55 9.60 0.0.00 正常 9.93±3.12 9.06±3.05 1.49 0.14 9.98±3.05 8.53±3.08 2.29 0.02 8.27±2.57 9.04±3.11 11.36±2.63 8.86 0.00 -
[1] Li T, Mello-Thoms C, Brennan PC. Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence [J]. Breast Cancer Res Treat, 2016, 159(3): 395-406. doi: 10.1007/s10549-016-3947-0 [2] Xu BH, Hu XC, Jiang ZF, et al. National consensus in China on diagnosis and treatment of patients with advanced breast cancer[J]. Ann Transl Med, 2015, 3(17): 242. http://europepmc.org/abstract/MED/26605288 [3] 田荣华, 王艳, 汪娇, 等. 钼靶X线对乳腺癌的诊断(附174例分析) [J]. 实用放射学杂志, 2011, 27(11): 1670-2. doi: 10.3969/j.issn.1002-1671.2011.11.015 [4] 胡少平, 尹定尧. 高分辨率CT与普通螺旋CT对乳腺癌的诊断价值比较[J]. 临床误诊误治, 2010, 23(7): 664-5. doi: 10.3969/j.issn.1002-3429.2010.07.048 [5] 丁勇俊, 范晓芳, 王卫理, 等. 动态增强MRI联合钼靶X线对乳腺癌的诊断价值[J]. 苏州大学学报: 医学版, 2009, 29(5): 966-8. https://www.cnki.com.cn/Article/CJFDTOTAL-SYXU200905053.htm [6] 王萌, 王春梅. 超声造影对乳腺癌的诊断价值[J]. 癌症进展, 2019, 17 (24): 2918-20. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ201924012.htm [7] 周克松, 邹翰琴. 颈动脉粥样斑块影像学检查方法现状及展望[J]. 西南医科大学学报, 2017, 40(3): 316-8. doi: 10.3969/j.issn.2096-3351.2017.03.023 [8] 赵志娟. 成纤维细胞活化蛋白在乳腺癌间质中的表达及其与微血管密度的关系[D]. 沈阳: 中国医科大学, 2006. [9] 潘俊. IRG1促进胶质瘤增殖的作用机制及临床意义[D]. 广州: 南方医科大学, 2015. [10] 王红梅, 徐军发. 肿瘤相关成纤维细胞与肿瘤相关性研究进展[J]. 国际肿瘤学杂志, 2012, 39(3): 163-6. doi: 10.3760/cma.j.issn.1673-422X.2012.03.001 [11] Phan-Lai V, Florczyk SJ, Kievit FM, et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells[J]. Biomacromolecules, 2013, 14(5): 1330-7. doi: 10.1021/bm301928u [12] Cun XL, Chen JT, Li MM, et al. Tumor-associated fibroblast-targeted regulation and deep tumor delivery of chemotherapeutic drugs with a multifunctional size-switchable nanoparticle[J]. ACS Appl Mater Interfaces, 2019, 11(43): 39545-59. doi: 10.1021/acsami.9b13957 [13] 张建兴, 蔡丽珊, 宋光辉, 等. 乳腺癌肿瘤大小与超声造影表现的相关性研究[J]. 南方医科大学学报, 2010, 30(9): 2187-9. https://www.cnki.com.cn/Article/CJFDTOTAL-DYJD201009047.htm [14] 吴芳, 成静, 马婷, 等. 不同分子分型乳腺癌的超声造影特征分析[J]. 临床超声医学杂志, 2019, 21(1): 1-4. doi: 10.3969/j.issn.1008-6978.2019.01.001 [15] 曾辉, 陈卫国, 徐泽园, 等. 不同分子分型原发乳腺癌临床病理特征及X线、超声表现: 140例23~35岁患者[J]. 分子影像学杂志, 2020, 43(3): 387-93. doi: 10.12122/j.issn.1674-4500.2020.03.05 [16] 李青, 朱玥涵. 超声造影在乳腺良恶性肿瘤鉴别诊断中的应用价值[J]. 影像研究与医学应用, 2020, 4(8): 71-2. https://www.cnki.com.cn/Article/CJFDTOTAL-YXYY202008039.htm [17] 冷晓玲. 乳腺癌超声造影特征与恶性基质化、肿瘤血管异质性区域性特点的相关性[D]. 乌鲁木齐: 新疆医科大学, 2015. [18] 王佳. 术中超声引导脑胶质瘤切除及其超声造影与微血管密度关系的研究[D]. 西安: 第四军医大学, 2009. [19] 李秋洋, 唐杰, 何恩辉, 等. 超声造影在鉴别膀胱上皮癌分级中的应用价值[J]. 中国医学科学院学报, 2012, 34(4): 364-8. doi: 10.3881/j.issn.1000-503X.2012.04.010 [20] 黄国福, 冷晓玲. 6种基质细胞在肺腺癌浸润前沿的分布特点[J]. 新疆医科大学学报, 2019, 42(11): 1409-13. doi: 10.3969/j.issn.1009-5551.2019.11.006 [21] Dudley WN, Benuzillo JG, Carrico MS. SPSS and SAS programming for the testing of mediation models[J]. Nurs Res, 2004, 53(1): 59-62. doi: 10.1097/00006199-200401000-00009 [22] Distelhorst SR, Cleary JF, Ganz PA, et al. Optimisation of the continuum of supportive and palliative care for patients with breast cancer in low-income and middle-income countries: executive summary of the Breast Health Global Initiative, 2014[J]. Lancet Oncol, 2015, 16 (3): e137-47. doi: 10.1016/S1470-2045(14)70457-7 [23] Nielsen Moody A, Bull J, Culpan AM, et al. Preoperative sentinel lymph node identification, biopsy and localisation using contrast enhanced ultrasound (CEUS) in patients with breast cancer: a systematic review and meta-analysis[J]. Clin Radiol, 2017, 72(11): 959-71. doi: 10.1016/j.crad.2017.06.121 [24] 林艳慧. 超声在涎腺肿物中的诊断研究[J]. 中国医药指南, 2016, 14 (24): 102. https://www.cnki.com.cn/Article/CJFDTOTAL-YYXK201624085.htm [25] 冷晓玲, 黄国福, 马富成. 乳腺癌超声造影充盈缺损与造影特征、临床病理参数的关系[J]. 中华超声影像学杂志, 2015(5): 417-21. doi: 10.3760/cma.j.issn.1004-4477.2015.05.014 [26] 杨云松, 江一舟, 胡欣, 等. 乳腺肿瘤微环境靶向治疗的研究进展[J]. 中国癌症杂志, 2019, 29(12): 977-84. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ201912013.htm [27] Wei X, Li Y, Zhang S, et al. Evaluation of thyroid cancer in Chinese females with breast cancer by vascular endothelial growth factor (VEGF), microvessel density, and contrast-enhanced ultrasound (CEUS)[J]. Tumor Biol, 2014, 35(7): 6521-9. doi: 10.1007/s13277-014-1868-2 [28] Jiang J, Chen YQ, Xu YZ, et al. Correlation between three-dimensional ultrasound features and pathological prognostic factors in breast cancer[J]. Eur Radiol, 2014, 24(6): 1186-96. doi: 10.1007/s00330-014-3135-8 [29] Zhang B, Hou YR, Chen T, et al. Microscopic study of ultrasoundmediated microbubble destruction effects on vascular smooth muscle cells[J]. Asian Pac J Trop Med, 2015, 8(4): 325-9. doi: 10.1016/S1995-7645(14)60339-4 [30] Barth PJ, Schenck zu Schweinsberg T, Ramaswamy A, et al. CD34+ fibrocytes, alpha-smooth muscle antigen-positive myofibroblasts, and CD117 expression in the stroma of invasive squamous cell carcinomas of the oral cavity, pharynx, and larynx[J]. Virchows Arch, 2004, 444(3): 231-4. doi: 10.1007/s00428-003-0965-1 [31] 崔亚洲. 间质成纤维细胞在乳腺癌血管生成中的作用[D]. 济南: 山东大学, 2003. [32] 张渊, 江泉, 陈建, 等. 乳腺肿瘤超声造影与微血管密度及血管内皮生长因子的相关性研究[J]. 中华超声影像学杂志, 2012, 21(1): 52-5. doi: 10.3760/cma.j.issn.1004-4477.2012.01.019 [33] Scimeca M, Urbano N, Bonfiglio R, et al. Novel insights into breast cancer progression and metastasis: a multidisciplinary opportunity to transition from biology to clinical oncology[J]. Biochim Biophys Acta Rev Cancer, 2019, 1872(1): 138-48. doi: 10.1016/j.bbcan.2019.07.002 -
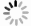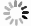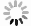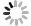





 下载:
下载: