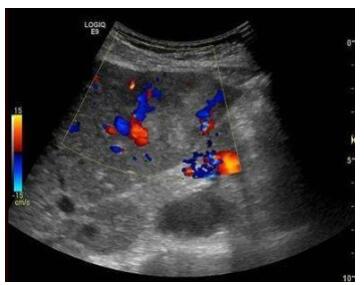
Correlation between peak time, peak acceleration time, enhancement rate and the degree of histological differentiation and malignant behavior of cancer cells in PLC patients
-
摘要:
目的 探索超声造影测定达峰时间、峰值加速时间、增强速率与原发性肝癌患者组织学分化程度及癌细胞恶性行为的关系。 方法 选择2015年2月~2019年2月我院60例原发性肝癌患者作为研究对象,根据患者的组织分化程度,分为低分化程度患者21例,中分化程度患者19例,高分化程度患者20例。所有患者经过病理检查,Ⅰ~Ⅱ期组患者35例,Ⅲ~Ⅳ期组患者25例,淋巴转移患者32例。分析不同病理状态、组织分化程度以及淋巴转移情况的增始时间、峰值时间、峰值增强强度、增强速率以及50%倾斜率之间的差异。 结果 低分化组、高分化组以及中分化组患者的增始时间、峰值时间、峰值增强强度、增强速率以及50%倾斜率之间的差异有统计学意义(P < 0.05)。经过两两比较,患者的峰值时间、增始时间、增强速率从高到低依次为高分化组、中分化组以及低分化组;患者的峰值时间、峰值增强强度以及50%倾斜率从高到低依次为低分化组、中分化组以及高分化组。Ⅲ~Ⅳ期组患者的增始时间、增强速率显著高于Ⅰ~Ⅱ期组(P < 0.05),Ⅲ~Ⅳ期组患者的峰值时间、峰值增强强度以及50%倾斜率显著低于Ⅰ~Ⅱ期组(P < 0.05)。淋巴转移组患者的增始时间、增强速率高于淋巴未转移组,淋巴转移组患者的峰值时间、峰值增强强度以及50%倾斜率低于淋巴未转移组(P < 0.05)。患者的淋巴转移情况、病理状态以及组织分化程度分别于增始时间、增强速率呈现正相关,患者的淋巴转移情况、病理状态以及组织分化程度分别于峰值时间、峰值增强强度以及50%倾斜率呈现负相关(P < 0.05)。 结论 超声造影测定达峰时间、峰值加速时间、增强速率与原发性肝癌患者的组织学分化程度及癌细胞恶性行为显著相关。 Abstract:Objective To explore the relationship between the peak time, peak acceleration time, enhancement rate and the degree of histological differentiation and malignant behavior of cancer cells in PLC patients. Methods From February 2015 to February 2019, 60 patients with primary liver cancer were selected. According to the degree of tissue differentiation, there were 21 patients with low differentiation, 19 patients with medium differentiation, 20 patients with high differentiation. All patients underwent pathological examination, 35 patients in stage I-II, 25 patients in stage III-IV and 32 patients with lymph metastasis. To analyze the difference among the different pathological state, the degree of tissue differentiation and the condition of lymph node metastasis in the beginning time, peak time, peak enhancement intensity, enhancement rate and 50% tilt rate were compared. Results The differences of the starting time, peak time, peak enhancement intensity, enhancement rate and 50% tilt rate between the low differentiation group, the high differentiation group and the middle differentiation group were significant. The peak time, peak enhancement intensity and 50% tilt rate of the patients were divided into low differentiation group, middle differentiation group and high differentiation group. The time and rate of enhancement in the stage Ⅲ-Ⅳ group were significantly higher than those in the stage Ⅰ-Ⅱ group. The peak time, peak intensity and 50% tilt rate in the stage Ⅲ-Ⅳ group were significantly lower than those in the stage Ⅰ-Ⅱ group. The time and rate of enhancement in the stage Ⅲ-Ⅳ group were significantly higher than those in the stage Ⅰ-Ⅱ group. The peak time, peak intensity and 50% tilt rate in the stage Ⅲ-Ⅳ group were significantly lower than those in the stage Ⅰ-Ⅱ group. In the group without lymph node metastasis, the lymph node metastasis, pathological state and the degree of tissue differentiation were positively correlated with the beginning time and the rate of enhancement respectively. The lymph node metastasis, pathological state and the degree of tissue differentiation were negatively correlated with the peak time, the peak intensity of enhancement and the 50% tilt rate respectively. Conclusions The peak time, peak acceleration time and enhancement rate measured by contrast-enhanced ultrasound are significantly related to the degree of histological differentiation and malignant behavior of cancer cells in patients with primary liver cancer. -
表 1 不同组织分化情况患者的超声参数比较
Table 1. Comparison of ultrasound parameters in patients with different tissue differentiation (Mean±SD)
组别 增始时间(s) 峰值时间(s) 峰值增强强度 增强速率 50%倾斜率 低分化组(n=21) 9.58±2.44 36.78±2.16 12.76±2.42 0.46±0.26 0.99±0.32 中分化组(n=19) 11.34±2.52 40.18±2.53 10.49±2.55 0.63±0.17 0.88±0.45 高分化组(n=20) 14.12±1.09 44.13±8.84 8.33±1.36 0.85±0.09 0.52±0.09 F 5.257 12.723 6.043 3.717 3.233 P 0.000 0.000 0.000 0.000 0.002 LSD-t(低分化vs中分化) 12.360 11.262 10.023 9.652 7.852 P 0.000 0.000 0.000 0.000 0.000 LSD-t(低分化vs高分化) 9.741 8.021 7.885 5.841 9.321 P 0.000 0.000 0.000 0.000 0.000 LSD-t(高分化vs中分化) 12.032 11.023 9.147 8.214 7.364 P 0.000 0.000 0.000 0.000 0.000 表 2 不同病理状态患者的超声参数比较
Table 2. Comparison of ultrasound parameters in patients with different pathological states (Mean±SD)
组别 增始时间(s) 峰值时间(s) 峰值增强强度 增强速率 50%倾斜率 Ⅲ-Ⅳ期组(n=35) 15.22±1.23 35.11±1.54 7.07±1.03 0.91±0.11 0.51±0.18 Ⅰ-Ⅱ期组(n=25) 13.45±1.01 37.34±1.17 9.11±1.09 0.79±0.14 0.62±0.10 t 9.450 6.088 7.383 3.717 3.021 P 0.000 0.000 0.000 0.000 0.004 表 3 不同淋巴转移情况患者的超声参数比较
Table 3. Comparison of ultrasound parameters in patients with different lymphatic metastasis (Mean±SD)
组别 增始时间(s) 峰值时间(s) 峰值增强强度 增强速率 50%倾斜率 淋巴转移组(n=32) 15.41±1.40 36.19±1.41 7.55±1.09 0.98±0.15 0.44±0.52 淋巴未转移组(n=28) 12.99±1.15 38.15±1.19 9.44±1.15 0.82±0.22 0.69±0.19 t 7.251 5.772 6.531 3.245 2.533 P 0.000 0.000 0.000 0.000 0.015 表 4 各指标相关性分析
Table 4. Correlation analysis of the indexes
指标 增始时间(s) 峰值时间(s) 峰值增强强度 增强速率 50%倾斜率 淋巴转移情况 r 0.523 -0.423 -0.623 0.412 -0.449 P 0.000 0.000 0.000 0.000 0.000 病理状态 r 0.412 -0.421 -0.365 0.399 -0.497 P 0.000 0.000 0.000 0.000 0.000 组织分化程度 r 0.412 -0.521 -0.254 0.527 -0.581 P 0.000 0.000 0.000 0.000 0.000 -
[1] 袁月德, 刘梅存.三维彩色多普勒超声与超声造影对鉴别诊断原发性肝癌及转移性肝癌的价值[J].中国医疗设备, 2018, 32(6): 78-81. doi: 10.3969/j.issn.1674-1633.2018.06.020 [2] 虞梅, 梅琪, 韩莹莹, 等.超声造影灌注时相分析在监控肝硬化结节演变和恶变中的临床价值[J].中国癌症杂志, 2019, 29(9): 709-14. http://d.old.wanfangdata.com.cn/Periodical/zgazzz201909005 [3] 杨志军, 赵丽娟.超声超微细彩色血管成像技术评价经肝动脉化疗栓塞治疗的原发性肝癌患者肿瘤血供效能初步应用研究[J].实用肝脏病杂志, 2018, 21(4): 509-12. doi: 10.3969/j.issn.1672-5069.2018.04.006 [4] 王国良, 徐贤刚, 刘隽, 等.精准肝切除术对原发性肝癌患者免疫功能及血清炎性因子的影响[J].安徽医药, 2018, 22(10): 1884-8. doi: 10.3969/j.issn.1009-6469.2018.10.008 [5] Wu J, Chen DC. Contrast-enhanced ultrasonography: A promising method for blood flow and perfusion evaluation in critically Ill patients [J]. Chin Med J, 2018, 131(10): 1135-7. doi: 10.4103/0366-6999.231527 [6] Leem G, Chung MJ, Park JY, et al. Clinical value of contrastenhanced harmonic endoscopic ultrasonography in the differential diagnosis of pancreatic and gallbladder masses[J]. Clin Endosc, 2018, 51(1): 80-8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3503265/ [7] Shiozawa K, Watanabe M, Ikehara T, et al. Efficacy of intra-arterial contrast-enhanced ultrasonography during transarterial chemoembolization with drug-eluting beads for hepatocellular carcinoma[J]. World J Hepatol, 2018, 10(1): 95-104. doi: 10.4254/wjh.v10.i1.95 [8] Yokode M, Shiomi H, Itai R, et al. Diagnostic utility of endoscopic ultrasonography elastography and contrast-enhanced harmonic endoscopic ultrasonography in a patient with type 2 autoimmune pancreatitis [J]. Jpn J Gastro - Enterol, 2018, 115(6): 563-72. https://pubmed.ncbi.nlm.nih.gov/29887592/ [9] Lee TH. Can contrast-enhanced harmonic endoscopic ultrasonography differentiate malignancy from benign disease[J]. Clin Endosc, 2018, 51(1): 5-7. doi: 10.5946/ce.2018.016 [10] Kim HS, Moon JH, Lee YN, et al. Prospective comparison of intraductal ultrasonography-guided transpapillary biopsy and conventional biopsy on fluoroscopy in suspected malignant biliary strictures [J]. Gut Liver, 2018, 12(4): 463-70. doi: 10.5009/gnl17205 [11] Yugawa K, Yoshizumi T, Harada N, et al. Multiple hepatic sclerosing hemangiomas: a case report and review of the literature[J]. Surg Case Rep, 2018, 4(1): 60-8. doi: 10.1186/s40792-018-0468-6 [12] Futai R, Sanuki T, Sawa H, et al. A case of intracholecystic papillary neoplasm of the gallbladder (ICPN) examined using contrast-enhanced endoscopic ultrasonography[J]. Jpn J Gastro - Enterol, 2018, 115(1): 117-25. https://pubmed.ncbi.nlm.nih.gov/29353848/ [13] Shi XC, Tang SS, Zhao W. Contrast-enhanced ultrasound imaging characteristics of malignant transformation of a localized type gallbladder adenomyomatosis: a case report and literature review [J]. J Cancer Res Ther, 2018, 14(Supplement): S263-6. doi: 10.4103/0973-1482.183208 [14] 杨亮, 顾玉明, 鹿皎, 等.超声造影与增强MRI在评价肝癌TACE术后疗效的应用比较[J].介入放射学杂志, 2019, 28(7): 682-6. http://d.old.wanfangdata.com.cn/Periodical/jrfsxzz201907016 [15] 何兰芳, 刘燕娜, 章春泉, 等.超声造影结合时间-强度定量参数评价肝癌消融术的疗效[J].中国老年学杂志, 2016, 36(9): 2166-8. doi: 10.3969/j.issn.1005-9202.2016.09.054 [16] Huang M, Zhao QY, Chen F, et al. Atypical appearance of hepatic hemangiomas with contrast-enhanced ultrasound[J]. Oncotarget, 2018, 9(16): 12662-70. doi: 10.18632/oncotarget.24185 [17] Cui GZ, Martin RC, Liu XK, et al. Serological biomarkers associate ultrasound characteristics of steatohepatitis in mice with liver cancer [J]. Nutr Metab (Lond), 2018, 15: 71. doi: 10.1186/s12986-018-0304-9 [18] Nuciforo S, Fofana I, Matter MS, et al. Organoid models of human liver cancers derived from tumor needle biopsies[J]. Cell Rep, 2018, 24(5): 1363-76. doi: 10.1016/j.celrep.2018.07.001 [19] Guo HB, Wang JH. Impact of contrast ultrasound diagnosis for patients with liver cancer[J]. Medicine (Baltimore), 2019, 98(19): e15445-9. doi: 10.1097/MD.0000000000015445 [20] 芮春平, 刘佳.超声弹性成像联合超声造影在鉴别原发性及转移性肝癌中的应用[J].影像科学与光化学, 2019, 37(4): 371-7. http://www.cqvip.com/QK/90163A/20194/7002490426.html [21] 雒大健, 全艳, 张志勇.超声造影与彩色多普勒超声在肝实质性肿块诊断中的对比研究[J].中国超声医学杂志, 2018, 34(8): 701-5. doi: 10.3969/j.issn.1002-0101.2018.08.009 -






 下载:
下载: