Prediction of peritumoral invasion of high grade gliomas by diffusion tensor imaging and 1H MRS
-
摘要:
目的 研究弥散张量成像(DTI)、氢质子磁共振波谱(1H MRS)影像表现对颅脑胶质瘤的鉴别诊断及对高级别胶质瘤瘤周浸润的预测价值。 方法 采取前瞻性研究,以2017年2月~2020年1月在我院进行治疗的69例颅脑胶质瘤患者作为研究对象,根据世界卫生组织2007年中枢神经系统肿瘤的病理分期情况分析,低级别胶质瘤患者36例,高级别胶质瘤患者33例,比较两组患者的DTI、1H MRS影像表现差异,分析DTI、1H MRS联合诊断对高级别胶质瘤瘤周浸润的诊断价值。 结果 低级别胶质瘤患者的ADC显著高于高级别胶质瘤(t=4.480,P < 0.001);在肿瘤组织中,低级别胶质瘤患者的NAA/Cr(t=8.477,P < 0.001)、Cho/ Cr(t=5.851,P < 0.001)、Lip+Lac/Cr(t=19.141,P < 0.001)低于高级别胶质瘤患者,Cho/NAA(t=2.493,P=0.015)高于高级别胶质瘤患者;在瘤周组织中,低级别胶质瘤患者的NAA/Cr(t=2.503,P=0.015)低于高级别胶质瘤患者,Cho/NAA(t=6.937,P < 0.001)、Cho/Cr(t=14.267,P < 0.001)、Lip+Lac/Cr(t=2.322,P=0.023)高于高级别胶质瘤患者;DTI、1H MRS联合诊断对高级别胶质瘤患者的诊断灵敏度显著高于单独检测。 结论 DTI、1H MRS影像表现对颅脑胶质瘤的鉴别诊断及对高级别胶质瘤瘤周浸润的预测效能较高,建议临床推广。 Abstract:Objective To explore the value of diffusion tensor imaging (DTI) and 1H MRS in the differential diagnosis of brain gliomas and in the prediction of peritumoral invasion of high-grade gliomas. Methods In this prospective study, 69 patients with brain glioma who were treated in our hospital from February 2017 to January 2020 were selected. According to the pathological staging of central nervous system tumor of who in 2007, there were 36 patients with low-grade glioma and 33 patients with high-grade glioma. The DTI and 1H of the two groups were compared to analyze the diagnostic value of DTI and 1H MRS in the diagnosis of peritumoral infiltration of high-grade gliomas. Result ADC of low-grade gliomas was significantly higher than that of high-grade gliomas (t=4.480, P < 0.001). NAA/Cr (t=8.477, P < 0.001), CHO/Cr (t=5.851, P < 0.001) and Lip + Lac/ Cr (t=19.141, P < 0.001) of low-grade gliomas were significantly lower than those of high-grade gliomas. CHO/NAA (t=2.493, P= 0.015) of low-grade gliomas were significantly higher than those of high-grade gliomas In tissues. NAA/Cr (t=2.503, P=0.015) of low-grade glioma patients was significantly lower than that of high-grade glioma patients, CHO/NAA (t=6.937, P < 0.001), CHO/ Cr (t=14.267, P < 0.001) and lip + Lac/Cr (t=2.322, P=0.023) of low-grade glioma patients were significantly higher than that of high-grade glioma patients; the diagnostic sensitivity of DTI and 1H MRS combined diagnosis was significantly higher than that of single detection. Conclusion DTI, 1H MRS imaging performance of brain glioma in the differential diagnosis and high-grade glioma peritumoral infiltration of high-grade predictive efficiency, it is recommended that clinical promotion. -
Key words:
- diffusion tensor imaging /
- 1H MRS /
- glioma /
- differential diagnosis
-
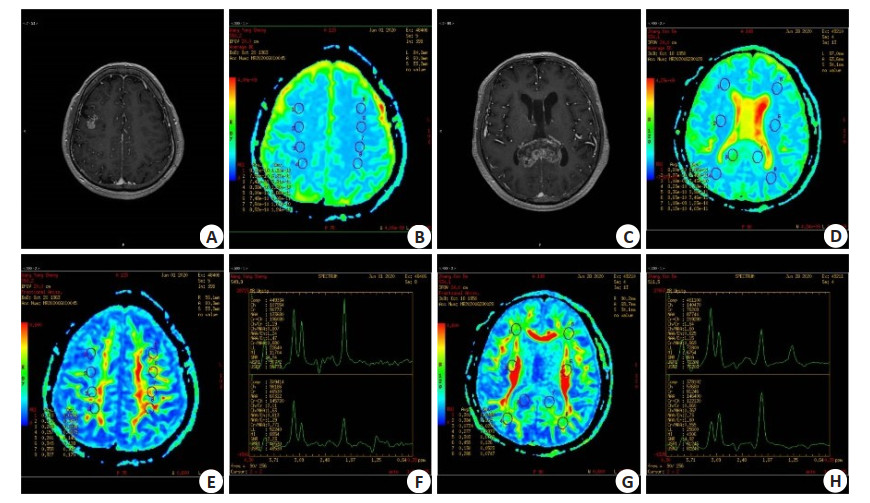
图 1 两组患者的DTI影像学结果比较
A:低级别胶质瘤增强扫描。颅脑MRI增强扫描示右侧额叶病灶明显强化,累及皮层及皮层下结构,轮廓不整,中心局部见小囊状无强化影;B:低级别胶质瘤ADC. 病灶ADC图信号无明显降低,或者说扩散不受限;C:高级别胶质瘤增强扫描. 颅脑MRI增强扫描示胼胝体压部病变不均匀明显强化,中心囊变、坏死区无强化,病变边界欠清晰;D:高级别胶质瘤ADC. 病灶ADC图信号明显降低,或者说扩散受限;E:FA图,测量FA值,病变区FA值较正常镜像区稍减低;F:1H MRS图,上图谱线正常,下图谱线显示Ch峰轻度升高,Ch/Cr比值轻度升高,提示肿瘤性病变;G:FA图,测量FA值,病变区FA值明显降低;H:1H MRS图,上图谱线为病变谱线图,Ch峰明显升高,Ch/Cr比值升高,高度提示肿瘤;下图为正常图.
Figure 1. Comparison of DTI imaging results between the two groups.
表 1 两组患者的一般资料比较
Table 1. Comparison of general data between the two groups
组别 性别(n, 男/女) BMI(kg/m2, Mean±SD) 年龄(岁, Mean±SD) 肿瘤部位(额叶/颞叶/顶叶) 低级别胶质瘤(n=36) 16/20 24.23±2.12 38.22±1.22 14/15/7 高级别胶质瘤(n=33) 19/14 24.30±1.97 38.32±2.33 12/15/6 χ2/t 1.192 0.142 0.220 0.102 P 0.276 0.887 0.826 0.951 表 2 两组患者肿瘤组织的1H MRS影像学结果比较
Table 2. Comparison of 1H MRS imaging results of tumor tissue between the two groups (Mean±SD)
组别 NAA/Cr Cho/Cr Cho/NAA Lip+Lac/Cr 低级别胶质瘤(n=36) 1.17±0.24 3.14±0.97 3.04±0.26 3.31±0.61 高级别胶质瘤(n=33) 1.61±0.19 4.53±1.00 2.75±0.62 7.14±0.99 t 8.477 5.851 2.493 19.141 P < 0.001 < 0.001 0.015 < 0.001 NAA: N-乙酰天门冬氨酸; Cr: 肌酐; Cho: 胆碱; Lip: 脂质; Lac: 乳酸. 表 3 两组患者瘤周组织的1H MRS影像学结果比较
Table 3. Comparison of 1H MRS imaging results of peritumoral tissues between the two groups (Mean±SD)
组别 NAA/Cr Cho/Cr Cho/NAA Lip+Lac/Cr 低级别胶质瘤(n=36) 1.42±0.64 1.68±0.15 1.27±0.09 0.66±0.26 高级别胶质瘤(n=33) 1.92±0.97 1.30±0.28 0.66±0.23 0.55±0.11 t 2.503 6.937 14.267 2.322 P 0.015 < 0.001 < 0.001 0.023 表 4 联合诊断效能比较
Table 4. Comparison of joint diagnostic efficacy
诊断方法 真阳例数(n) 假阳例数(n) 真阴例数(n) 假阴例数(n) 准确率(%) 敏感度(%) 特异性(%) 阳性预测值(%) 阴性预测值(%) 1H MRS 30 15 21 3 73.91 90.91 41.18 66.67 87.50 DTI 31 17 19 2 72.46 93.94 38.00 64.58 90.48 联合诊断 32 22 14 1 66.67 96.97 30.43 59.26 93.33 -
[1] 查昳琳, 徐晓婷. 多模态MRI在高级别脑胶质瘤放疗中的应用[J]. 中华放射肿瘤学杂志, 2019, 28(3): 226-9. doi: 10.3760/cma.j.issn.1004-4221.2019.03.014 [2] 符念霞, 宋建勋, 罗泽斌. 多模态MR功能成像技术评估高级别胶质瘤瘤周浸润的价值[J]. 实用放射学杂志, 2019(12): 1897-900, 1939. doi: 10.3969/j.issn.1002-1671.2019.12.003 [3] 王晓青, 曹梦秋, 所世腾, 等. 基于全肿瘤ADC图纹理特征预测术前WHO Ⅱ~Ⅲ级别胶质瘤IDH1基因表达类型效能的初步探讨[J]. 中国临床医学影像杂志, 2020, 31(10): 685-9. https://www.cnki.com.cn/Article/CJFDTOTAL-LYYX202010003.htm [4] 徐庆生, 叶科, 胡炽, 等. 多模态影像融合技术在颅内病变立体定向活检中的应用[J]. 中华神经外科杂志, 2018, 34(4): 349-52. doi: 10.3760/cma.j.issn.1001-2346.2018.04.006 [5] Jeong HY, Kim HJ, Kim CE, et al. High expression of RFX4 is associated with tumor progression and poor prognosis in patients with glioblastoma[J]. Int J Neurosci, 2021, 131(1): 7-14. doi: 10.1080/00207454.2020.1732969 [6] Liu X, Wu P, Su R, et al. IGF2BP2 stabilized FBXL19-AS1 regulates the blood-tumour barrier permeability by negatively regulating ZNF765 by STAU1-mediated mRNA decay[J]. RNA Biol, 2020, 17(12): 1777-88. doi: 10.1080/15476286.2020.1795583 [7] Xu D, Zhou XD, Niu XF, et al. Automatic segmentation of low-grade glioma in MRI image based on UNet ++ model[J]. J Phys: Conf Ser, 2020, 1693: 012135. doi: 10.1088/1742-6596/1693/1/012135 [8] Pellerino A, Bruno F, Internò V, et al. Current clinical management of elderly patients with glioma[J]. Expert Rev Anticancer Ther, 2020, 20(12): 1037-48. doi: 10.1080/14737140.2020.1828867 [9] Chu T, Seah SH, Lim YP. Signal transduction of a novel WBP2 oncogene[J]. Proc Singapore Natl Acad Sci, 2020, 14(1): 3-13. doi: 10.1142/S2591722620400013 [10] Yuan Y, Zhao H, Guo Y, et al. A Programmable Hybrid DNA Nanogel for Enhanced Photodynamic Therapy of Hypoxic Glioma [J]. Trans Tianjin Univ, 2020, 26(6): 450-7. doi: 10.1007/s12209-020-00260-w [11] Imyanitov EN, Levchenko EV, Kuligina ES, et al. Treating non-small cell lung cancer with selumetinib: an up-to-date drug evaluation[J]. Expert Opin Pharmacother, 2020, 21(16): 1943-53. doi: 10.1080/14656566.2020.1798930 [12] Lu H, Yin M, Wang L, et al. FGF13 interaction with SHCBP1 activates AKT-GSK3α/β signaling and promotes the proliferation of A549 cells[J]. Cancer Biol Ther, 2020, 21(11): 1014-24. doi: 10.1080/15384047.2020.1824512 [13] Wang J, Zhang Y, You A, et al. HAS2-AS1 Acts as a molecular sponge for miR-137 and promotes the invasion and migration of glioma cells by targeting EZH2[J]. Cell Cycle, 2020, 19(21): 2826-35. doi: 10.1080/15384101.2020.1826237 [14] Kim YH, Tran TAT, Duong THO, et al. Feasibility of dendritic cell-based vaccine against glioblastoma by using cytoplasmic transduction peptide (CTP)-fused protein antigens combined with anti-PD1[J]. Hum Vaccines Immunother, 2020, 16(11): 2840-8. doi: 10.1080/21645515.2020.1732165 [15] Warsi NM, Zewude R, Karmur B, et al. The cost-effectiveness of 5-ALA in high-grade glioma surgery: a quality-based systematic review[J]. Can J Neurol Sci, 2020, 47(6): 793-9. doi: 10.1017/cjn.2020.78 [16] Ye B, Shi J, Kang H, et al. Advancing Pan-cancer gene expression survial analysis by inclusion of non-coding RNA[J]. RNA Biol, 2020, 17(11): 1666-73. doi: 10.1080/15476286.2019.1679585 [17] 黄颖倩, 赵静, 初建平, 等. 基于不同扩散模型的扩散加权成像在脑胶质瘤分级和预测IDH-1突变的对比分析[J]. 中山大学学报: 医学科学版, 2021, 42(1): 87-94. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSYK202101012.htm [18] 吴静, 沈慧聪. 脑胶质瘤磁共振弥散张量成像定量参数与VEGF、MMP-9表达的相关性[J]. 影像科学与光化学, 2021, 39(1): 115-9. https://www.cnki.com.cn/Article/CJFDTOTAL-GKGH202101022.htm [19] 李虹, 韩奕勃, 呼虹宇, 等. 弥散张量成像在检测颅内肿瘤与周围脑白质神经纤维束解剖关系中的临床应用价值[J]. 中国医科大学学报, 2020, 49(12): 1125-9. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYK202012014.htm [20] 肖冬玲, 唐光才, 陈光祥, 等. 脑胶质瘤扩散张量成像定量参数与肿瘤细胞ki-67及survivin表达的相关性[J]. 中国医学影像学杂志, 2020, 28(12): 928-31, 933. doi: 10.3969/j.issn.1005-5185.2020.12.011 [21] 曾盛熊, 王成伟, 彭少华. DTI在Ⅱ、Ⅲ级胶质瘤鉴别诊断中的应用价值[J]. 临床放射学杂志, 2020, 39(7): 1253-7. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS202007004.htm -
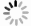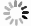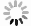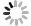






 下载:
下载: